Хімія. 8 клас. Ярошенко
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 36. Загальні хімічні властивості оксидів
Вивчення параграфа допоможе вам:
- складати рівняння реакцій, що характеризують хімічні властивості оксидів;
- ознайомитися з новим типом реакцій — реакціями обміну;
- застосовувати знання номенклатури оксидів;
- розрізняти несолетворні й солетворні оксиди;
- доповнити знання про класифікацію речовин класифікацією оксидів;
- повторити правила номенклатури солей;
- розвивати уміння здійснювати класифікацію речовин.
Оксиди хімічно досить активні речовини. Для них характерною є взаємодія з: 1) водою; 2) кислотами; 3) лугами; 4) іншими оксидами. Перейдемо до розгляду зазначених властивостей.
1. ВЗАЄМОДІЯ ОКСИДІВ З ВОДОЮ. Цю властивість оксидів детально розглянуто в попередньому параграфі. Наголосимо лише на тому, що:
- з водою взаємодіють оксиди металічних елементів, розташованих у І і ІІ групах головних підгруп (виняток Берилій, Магній). Продуктами взаємодії є луги — розчинні основи;
- більшість оксидів неметалічних елементів взаємодіють із водою з утворенням кислот.
З'ясувати інші хімічні властивості оксидів допоможуть демонстраційні досліди.
2. ВЗАЄМОДІЯ ОКСИДІВ З КИСЛОТАМИ. ОСНОВНІ ОКСИДИ. Якщо з кислотами взаємодіють лише метали, розташовані у витискувальному ряді до водню (див. § 4), то стосовно оксидів металічних елементів таких обмежень немає. З кислотами взаємодіють оксиди як металічних елементів, розташованих у витискувальному ряді до водню, так і металічних елементів, розташованих у ньому після водню. Підтвердимо це дослідами.
Дослід 1. Помістимо у пробірку кілька грамів магній оксиду — твердої, нерозчинної у воді речовини білого кольору — і доллємо до нього 2-3 мл розчину нітратної кислоти. Для прискорення перебігу реакції вміст пробірки підігріємо. Через невеликий проміжок часу осад зникає (мал. 51).

Мал. 51. Ілюстрація досліду 1
Це хімічне явище описують таким рівнянням реакції.
![]()
Як бачимо, продуктом реакції є сіль і вода.
Дослід 2. Помістимо у пробірку кілька грамів купрум(ІІ) оксиду — твердої, нерозчинної у воді речовини чорного кольору — і доллємо до нього 2-3 мл розчину сульфатної кислоти. Для прискорення перебігу реакції вміст пробірки підігріємо. Досить швидко помітимо, що рідина у пробірці набуває блакитного кольору, а вміст у ній купрум(ІІ) оксиду зменшується (мал. 52).

Мал. 52. Ілюстрація досліду 2
Поява кольору свідчить про перебіг хімічного явища.

Як і в попередньому досліді, продуктами реакції є сіль і вода.
Оксиди, що взаємодіють із кислотами з утворенням солей, називають основними оксидами. До них належать виключно оксиди металічних елементів, з невеликим значенням валентності — I, II, рідше ІІІ (ступенями окиснення +1, +2, +3). Гідратами цих оксидів є основи.
РЕАКЦІЇ ОБМІНУ. Пригадайте визначення реакцій приєднання, розкладу, заміщення і спробуйте визначити тип розглянутих хімічних реакцій 1 та 2. Аналіз складу речовин до та після реакції свідчить про те, що ці рівняння не належать до жодної з них. Вочевидь, це новий тип хімічних реакцій.
Що в ньому особливого? Він характеризується відсутністю простих речовин, а по-друге, реагентами та продуктами реакції є дві складні речовини.
Реакція, під час якої дві складні речовини обмінюються складовими частинами, унаслідок чого утворюються нові складні речовини, називається реакцією обміну.
Скориставшись рівнянням реакції обміну між купрум(ІІ) оксидом та сульфатною кислотою, проілюструємо схематично це визначення.
CuO + H2SO4 → CuSO4+ H2O
![]()
Як вам відомо, першою складовою основних оксидів є металічний елемент, другою — Оксиген. Першою складовою кислот є Гідроген, другою — кислотний залишок. У поданому рівнянні перші частини складних речовин зафарбовані в синій колір, другі — у червоний. Це дає змогу легко помітити, що оксид обміняв свою другу складову — Оксиген — на другу складову кислоти — кислотний залишок й утворилася сіль. Якщо ж розглядати кислоту, то можемо сказати, що її перша складова — атоми Гідрогену — помінялася місцями з атомом металічного елемента, а отже, вони сполучилися з Оксигеном й утворили воду.
3. ВЗАЄМОДІЯ ОКСИДІВ З ЛУГАМИ. КИСЛОТНІ ОКСИДИ. Проведемо дослід, відомий вам ще з природознавства, — взаємодію вуглекислого газу з вапняною водою, тобто розчином лугу, кальцій гідроксиду Са(ОН)2.
Дослід 3. Наллємо у пробірку 2-3 мл прозорого розчину кальцій гідроксиду (вапняної води). У прилад для добування газів помістимо шматочки мармуру, основна складова якого — кальцій карбонат, і додамо хлоридної кислоти. Відкриємо затискач на газовідвідній трубці. Кислота почне взаємодіяти з кальцій карбонатом, спостерігатиметься активне виділення вуглекислого газу.

Вуглекислий газ газовідвідною трубкою надходить до посудини з вапняною водою, і прозорий розчин досить швидко мутніє. Напишемо рівняння реакції та з'ясуємо, яка з утворених речовин випала в осад (у хімії будь-яке помутніння називають осадом, бо воно спричинене утворенням нерозчинної речовини).
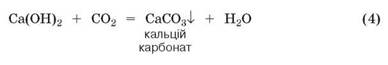
Як і в попередніх дослідах з оксидами металічних елементів, продуктами цієї реакції є дві складні речовини — сіль і вода. Але цього разу в утворенні солі взяв участь оксид неметалічного елемента.
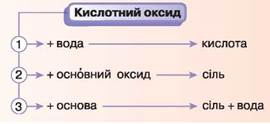
Оксиди, які взаємодіють з основами й утворюють сіль, називають кислотними оксидами.
До кислотних оксидів належить більшість оксидів неметалічних елементів, а також оксиди металічних елементів із високою валентністю (ступенями окиснення +4 і більше).
4. ВЗАЄМОДІЯ ОСНОВНИХ І КИСЛОТНИХ ОКСИДІВ МІЖ СОБОЮ. Основні оксиди взаємодіють із кислотними оксидами.

Ця взаємодія характерна для оксидів, гідратами яких є розчинні основи — луги.
Зверніть увагу! Утворені солі мають кислотний залишок кислоти, яка відповідає взятому для реакції кислотному оксиду.
Поміркуйте, до якого типу хімічних реакцій належить взаємодія основних оксидів із кислотними.
ПОНЯТТЯ ПРО СОЛЕТВОРНІ Й НЕСОЛЕТВОРНІ ОКСИДИ. Розглянуті в цьому параграфі приклади хімічних явищ свідчать про те, що з оксиду можна добути сіль, подіявши на нього кислотою чи лугом. Проте деякі оксиди цієї властивості не виявляють. Це стосується карбон(ІІ) оксиду СО, нітроген(І) оксиду N2O, нітроген(ІІ) оксиду NO, гідроген оксиду Н2О. За цією класифікаційною ознакою здійснено поділ оксидів на солетворні та несолетворні.
КЛАСИФІКАЦІЯ ОКСИДІВ. Узагальнимо у вигляді схеми розглянутий у процесі вивчення хімічних властивостей оксидів поділ речовин цього класу на групи. Як видно зі схеми 17 (див. с. 190), серед солетворних оксидів виділяють основні, кислотні та амфотерні оксиди. З представниками основних і кислотних оксидів, а також їх визначеннями ви щойно ознайомилися. Амфотерні оксиди та їх гідрати вивчатимете далі окремим параграфом.
Наведіть приклади солетворних оксидів.
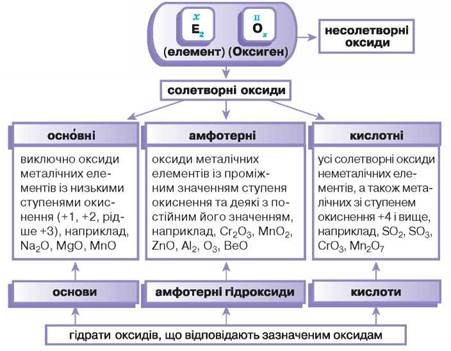
Схема 17. Класифікація оксидів
Попрацюйте групами
Розгляньте схему 17 і дізнайтеся, які гідрати оксидів відповідають кожній групі. Складіть їх формули для поданих у схемі формул оксидів.
Хімія — це життя: сторінка природодослідника
Завдання. Здійсніть уявний експеримент із розпізнавання таких речовин: кальцій оксид, фосфор(V) оксид.
1. Складіть план розпізнавання.
2. Запишіть рівняння реакцій та зазначте явища, на яких ґрунтувалося розпізнавання вами цих речовин.
Стисло про основне
• За здатністю взаємодіяти з іншими речовинами та утворювати солі оксиди поділяють на солетворні та несолетворні.
• Солетворні оксиди поділяють на основні, кислотні, амфотерні.
• Основним оксидам відповідають гідрати оксидів основи, кислотним — кислоти.
• Основні оксиди взаємодіють із водою, кислотами, кислотними оксидами.

• Кислотні оксиди взаємодіють із водою, основами (лугами), основними оксидами.
Сторінка ерудита
У параграфі розглянуто загальні хімічні властивості оксидів. Сполукам цього класу властива й інша взаємодія, зокрема доокиснення. З назви легко здогадатися, що ця реакція пов'язана з киснем. Справді, якщо елемент в оксиді виявляє нижчий ступінь окиснення, то за певних умов оксид із нижчим значенням ступеня окиснення можна окиснити до оксиду з вищим ступенем окиснення.
2СО + О2 = 2СО2
2SO2 + О2 = 2SO3
Визначте валентність Карбону та Сульфуру до та після реакції. Зробіть висновок.
Доокиснення оксидів пов'язане з такими екологічно небезпечним явищем, як кислотні дощі (про них ітиметься пізніше).
Знаємо, розуміємо
1. Назвіть відому вам класифікацію оксидів.
2. Дайте визначення основних оксидів, наведіть приклади.
3. У чому виявляється специфіка кислотних оксидів? Наведіть приклади.
4. Наведіть приклади несолетворних оксидів.
5. Які властивості основних оксидів вам відомо?
6. Назвіть властивості кислотних оксидів.
Застосовуємо
125. Із поданого переліку формул оксидів випишіть окремо формули й назвіть їх за сучасною українською номенклатурою:
а) основні оксиди; б) кислотні оксиди; в) амфотерні оксиди:
Cl2O7, FeO, P2O5, CO2, K2O, ZnO, Al2O3, WO3.
126. З якими з перелічених речовин взаємодіє магній оксид: кисень, хлоридна кислота, барій оксид, калій гідроксид, натрій хлорид, карбон(IV) оксид? Напишіть рівняння реакцій, що відбуваються.
127. Установіть відповідність між оксидом і групою, до якої він належить.
- 1 сульфур(IV) оксид
- 2 алюміній оксид
- 3 калій оксид
- А несолетворний
- Б основний
- В амфотерний
- Г кислотний
128. Проаналізуйте твердження 1 і 2 та оберіть правильний варіант відповіді.
Твердження 1. Натрій оксид взаємодіє з водою.
Твердження 2. Купрум(ІІ) оксид не взаємодіє з водою.
- А Правильне лише твердження 1
- Б Правильне лише твердження 2
- В Правильні обидва твердження
- Г Неправильні обидва твердження
129. Виберіть зайву формулу в кожному переліку:
- а) К2О, N2O, Fe2O3;
- б) ВаО, Mn2O7, К2О;
- в) SiO2, МnO, SO3.
Аргументуйте свій вибір.
130. Напишіть рівняння можливих реакцій за поданими схемами.
- а) FeO + H2O →
- б) BaO + H2O →
- в) N2O5 + CO2 →
- г) SrO + SO2→
- д) ZnO + H2O →
- е) K2O + CO2 →
- є) BaO + SO3→
- ж) CaO + P2O5→
- з) MgO + O2 →
- і) CaO + SiO2 →
- к) CuO + H2→
- л) SO3 + CO2→
- м) Na2O + CO →
Цей контент створено завдяки Міністерству освіти і науки України
