Хімія. Повторне видання. 9 клас. Савчин
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 17. Окисно-відновні реакції. Процеси окиснення та відновлення, окисники й відновники
Вивчивши матеріал параграфа, ви зможете:
- знати й розуміти суть понять «окисно-відновні реакції», «процес окиснення», «процес відновлення», «окисник», «відновник», «електронний баланс»;
- розрізняти окисно-відновні реакції та реакції, що відбуваються без зміни ступеня окиснення;
- характеризувати процеси окиснення та відновлення, роль окисно-відновних процесів у довкіллі;
- складати рівняння найпростіших окисно-відновних реакцій на основі електронного балансу;
- висловлювати судження про значення окисно-відновних реакцій.
• Пригадайте, що таке ступінь окиснення елемента та як його визначають за хімічними формулами речовин.
За ознакою зміни ступенів окиснення елементів, що містяться в складі речовин, реакції поділяють на окисно-відновні й такі, що відбуваються без зміни ступеня окиснення.
Реакції, що відбуваються без зміни ступеня окиснення елементів. Серед реакцій, які ви вивчали, трапляються такі, що відбуваються без зміни ступеня окиснення хімічних елементів і з його зміною.
Розглянемо кожний із цих типів реакцій. Наприклад, вам уже відома реакція розкладу нерозчинної у воді основи купрум(ІІ) гідроксиду. З’ясуємо, які ступені окиснення елементів у реагентах і продуктах реакції. Ви пам’ятаєте, що ступені окиснення записують над символами елементів і, на відміну від зарядів йонів, спочатку ставлять знак «+» або «-», а потім його числове значення +2, -2:
![]()
У запропонованому рівнянні реакції ступені окиснення кожного елемента до й після реакції не змінилися.
Розглянемо інший приклад — реакцію обміну між електролітами в розчині і визначимо ступені окиснення елементів:
![]()
У цій реакції ступені окиснення елементів також не змінюються.
Окисно-відновні реакції. Зауважимо, що не всі реакції розкладу відбуваються без зміни ступенів окиснення.
Розглянемо реакцію розкладу води під дією постійного електричного струму (рис. 48). Запишемо рівняння реакції:
![]()
Проставимо ступені окиснення елементів:
![]()
Унаслідок цієї реакції утворюються два гази: кисень і водень. Вам відомо, що ступінь окиснення елементів у простих речовинах дорівнює нулю. Отже, реакція розкладу води відбувається зі зміною ступенів окиснення елементів.
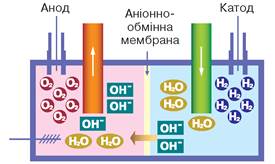
Рис. 48. Розклад води під дією постійного електричного струму
Наведемо ще один приклад:
![]()
Унаслідок цієї реакції ступені окиснення елементів Феруму й Гідрогену змінилися.
Хімічні реакції, що відбуваються зі зміною ступенів окиснення елементів реагентів і продуктів реакції, називають окисно-відновними.
Що ж є причиною зміни ступенів окиснення елементів під час окисно-відновних реакцій? Така зміна відбувається внаслідок переходу електронів від одних частинок атома до інших або зміщення електронної густини між атомами реагентів реакції.
В окисно-відновних реакціях одночасно відбуваються два взаємопов’язані процеси: окиснення та відновлення.
Окиснення — це процес, під час якого частинки реагентів реакції віддають електрони.
Відновлення — процес приєднання електронів частинками реагентів.
Розглянемо ці процеси на прикладі реакції взаємодії алюмінію з хлором:
![]()
Внаслідок реакції ступінь окиснення Алюмінію змінився з 0 до +3, тобто атом Алюмінію віддав 3 електрони. Цей процес записують таким електронним рівнянням:
![]()
Отже, відбувся процес окиснення.
Ці 3 електрони перейшли до Хлору, де кожний атом приєднав по одному з них, і Хлор набув ступінь окиснення -1.
Отже, згідно з електронним рівнянням
![]()
відбувся процес відновлення (молекула Хлору приймає 2 електрони).
Важливо зазначити, що процес окиснення завжди супроводжується процесом відновлення. Атоми, молекули чи йони, які віддають електрони, називають відновниками. Атоми, молекули або йони, які приєднують електрони, називають окисниками.
Оскільки під час окисно-відновних реакцій відбуваються 2 процеси одночасно, кількість електронів, що віддає відновник, завжди дорівнює кількості електронів, які приєднує окисник.
Ураховуючи це правило, у реакції між алюмінієм і хлором необхідно дібрати коефіцієнти.
Метод електронного балансу. Цей метод застосовують для добору коефіцієнтів в окисно-відновних реакціях.
Щоб скласти рівняння реакції на основі електронного балансу, після запису молекулярного рівняння треба записати електронні рівняння.
1. Повторюємо їхній запис:

2. Проводимо вертикальну риску й виписуємо за нею кількість електронів, що віддали й приєднали атоми Алюмінію та Хлору.
3. Визначаємо найменше спільне кратне для чисел 3 і 2. Це число б, яке записуємо за другою вертикальною рискою посередині.
4. Ділимо найменше спільне кратне почергово на 3 і 2 й записуємо результат за третьою рискою в рядках, що стосуються елементів Алюмінію та Хлору. Ці числа відповідають коефіцієнтам. У молекулярному рівнянні перед алюмінієм (відновником) ставимо коефіцієнт 2, а перед хлором (окисником) — 3. Добираємо коефіцієнт для алюміній хлориду. Він становить 2. Правильно записане рівняння:
2Аl + 3Сl2 = 2АlСl3.
Розглянемо ще один приклад окисно-відновної реакції та складемо електронний баланс:

Біля гідроген сульфіду (відновника) ставимо коефіцієнт 2, а біля кисню (окисника) — 3.
У правій частині молекулярного рівняння поставимо коефіцієнти так, щоб їхнє числове значення відповідало кількості атомів у лівій частині рівняння.
Отже, рівняння окисно-відновної реакції має такий вигляд:
2H2S + 3О2 = 2SO2 + 2Н2О.
Відновниками в окисно-відновних реакціях є атоми металічних елементів (Na, К, Mg, Zn, Al), неметали (H2,С ), йони безоксигенових кислот Сl-, Вr-, I-, а також йони металічних елементів із нижчими ступенями окиснення:
![]()
До окисників належать кисень, хлор, бром, йод, сірка, нітратна й сульфатна кислоти тощо.
Значення окисно-відновних реакцій. Окисно-відновні реакції мають важливе значення у природі, техніці та житті людини. З курсу біології вам відомо, що вивільнення кисню в атмосферу та підтримування його постійного вмісту в ній відбуваються внаслідок процесу фотосинтезу (рис. 49). Його суть полягає в тому, що з вуглекислого газу й води під дією світла утворюються глюкоза (органічна речовина) і кисень. Рівняння реакції:
6СО2 + 6Н2О = С6Н12О6 + 6O2↑.

Рис. 49. Схема процесу фотосинтезу
Завдяки окисно-відновним процесам ми дихаємо. Унаслідок цих процесів в організмах людини, рослин і тварин відбувається обмін речовин. За їх участю перетравлюється їжа.
Окисно-відновні процеси відбуваютья в атмосфері під час грози. Кисень за високих температур взаємодіє з азотом з утворенням нітроген(ІІ) оксиду, який окиснюється до нітроген(ІV) оксиду. Ці реакції належать до окисно-відновних і відбуваються за такими схемами:
N2 + О2 → NO; NO + О2 → NO2.
• Перетворіть схеми на рівняння реакцій, дібравши коефіцієнти методом електронного балансу.
Більшість процесів у природі відбуваються завдяки окисно-відновним реакціям. Це, зокрема, іржавіння заліза за наявності кисню та вологи; окиснення інших металів — алюмінію, міді й цинку; процеси бродіння; гниття органічних решток; колообіги кисню, азоту й води; самоочищення водойм; виверження вулканів; утворення в земній корі корисних копалин і мінералів.
• Опишіть, де використовують окисно-відновні реакції в побуті.
Окисно-відновні процеси застосовують у промисловості для відновлення металів із руд (рис. 50), виплавлення чавуну та сталі, виробництва мінеральних добрив, барвників, гормонів росту рослин. У фармацевтичній промисловості окисно-відновні процеси застосовують під час синтезу лікарських препаратів, а в хімічній — для одержання хлоридної, сульфатної, нітратної та інших кислот, лугів, амоніаку, лужних металів і галогенів.

Рис. 50. Схема окисно-відновної реакції
Поглибити свої знання про окисно-відновні реакції та їхню користь для людини ви зможете, вивчаючи органічні сполуки.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• За зміною ступеня окиснення елементів реагентів реакції поділяють на реакції, що відбуваються без зміни ступеня окиснення, та окисно-відновні реакції.
• Хімічні реакції, що відбуваються зі зміною ступенів окиснення елементів реагентів і продуктів реакції, називають окисно-відновними.
• Ступінь окиснення елементів змінюється внаслідок переходу електронів від одних частинок в інші або перерозподілу електронної густини між атомами реагентів у реакції.
• Окиснення — процес, під час якого частинки реагентів реакції віддають електрони.
• Відновлення — процес приєднання електронів частинками реагентів.
• Атоми, молекули чи йони, які віддають електрони, називають відновниками. Атоми, молекули або йони, які приєднують електрони, називають окисниками.
• Кількість електронів, що віддає відновник, завжди дорівнює кількості електронів, які приєднує окисник.
• Метод електронного балансу використовують для добору коефіцієнтів в окисно-відновних реакціях.
• Окисно-відновні процеси мають важливе значення в природі, практичне застосування в побуті та багатьох виробництвах (наприклад, металургії).
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Уставте пропущені слова, щоб висловлювання стало завершеним.
Реакції, які відбуваються зі зміною ... ..., називають ... .
Елемент, який ... електрони і ..., є відновником.
Елемент, який ... електрони і ..., є окисником.
Метод, за допомогою якого добирають коефіцієнти для окисно-відновних реакцій, називають... .
2. Окисно-відновні реакції відображають наведені нижче схеми.
- Α Ζn + Ο2 →
- Б ВаО + Н2О →
- В СаО + НСl →
- Г Mg + НСl →
3. Зазначте в наведених схемах ступені окиснення елементів до й після реакції та встановіть, який елемент окиснився, а який відновився: а) Аl + НСl → АlСl3 + H2↑; б) Mg + Br2 → MgBr2; в) КСlО3 → КСl + O2↑; г) Сr + Сl2 → СrСl3; ґ) Zn + H2SO4 → ZnSO4 + H2↑; д) Ca + H2O → Ca(OH)2 + H2↑.
4. Допишіть рівняння реакцій і класифікуйте їх на окисно-відновні й такі, що відбуваються без зміни ступенів окиснення: a) Na2O + Н2О → ... ; б) Н2О2 → ... ; в) Mg + Н3РО4 → ... ; г) Fe + Сl2 → ... ; ґ) ZnO + HNO3 → ... ; д) Ва + Н2О → ... .
5. Допишіть рівняння реакцій. Доберіть коефіцієнти методом електронного балансу, укажіть окисник і відновник: а) Al + F2 → ... ; б) Fe + НВr → ... ; в) К + Н2О → ... ; г) Mg + НСl → ... ; ґ) Zn + H2SO4 → ... ; д) Na + Н2О → ... ; е) СuО + Н2 → ... ; є) Р + О2 → ... .
6. Охарактеризуйте процеси, що відбуваються, користуючись схемами. Складіть рівняння відповідних реакцій. Доберіть коефіцієнти методом електронного балансу:
![]()
7. Допишіть пропущені продукти реакцій. Доберіть коефіцієнти методом електронного балансу, укажіть окисник і відновник: а) РН3 + О2 → Р2О5 + ... ; б) Fe + НСl → ... + Н2; в) Na + Н2О → NaOH + ... ; г) НgО → Нg + ... ; ґ) SO2 + О2 → ... ; д) Ва + Н2О → Ва(ОН)2 + ... .
8. Складіть рівняння реакцій за наведеною схемою: Ζn → ΖnΟ → Ζn(ΝΟ3)2 → Ζn(ΟΗ)2 → ΖnΟ → Ζn. Укажіть тип кожної реакції, виокремте серед них окисно-відновні. Обчисліть масу цинк нітрату, якщо прореагував цинк масою 19,5 г.
9. До розчину масою 117 г із масовою часткою натрій хлориду 0,1 долили розчин арґентум(І) нітрату до повної взаємодії. Обчисліть масу й кількість утвореної нерозчинної речовини, що випала в осад. Назвіть продукти реакції.
Цей контент створено завдяки Міністерству освіти і науки України
