Хімія. 9 клас. Савчин
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 5. БУДОВА МОЛЕКУЛИ ВОДИ, ПОНЯТТЯ ПРО ВОДНЕВИЙ ЗВ'ЯЗОК
Опанувавши матеріал параграфа, ви зможете:
- знати будову молекули води;
- формулювати визначення понять «водневий зв'язок», «диполь»;
- розуміти, чому вода є хорошим розчинником багатьох речовин;
- пояснювати роль води в житті живих організмів; будову молекули води з погляду електронної теорії будови атома;
- обґрунтовувати унікальну здатність води розчиняти речовини;
- висловлювати судження про значення розчинів у природі та житті людини.
• Пригадайте, що вам відомо про поширення води в природі, її склад, властивість як розчинника.
Поширення води в природі. На нашій планеті вода є однією з найпоширеніших речовин, яка перебуває за звичайних умов у рідкому стані та заповнює всі впадини земної поверхні. Вода — це моря, океани, річки, озера, що займають майже 71 % площі земної поверхні. Якщо припустити, що земна поверхня не має впадин і гір, то вся вода нашої планети вкрила б її шаром завтовшки 4 км. Вода входить до складу гірських порід і мінералів.
Порівняно з великими загальними запасами води на планеті запаси прісної води є незначними й становлять приблизно 2-3 % від загальної кількості. Надходження прісної води відбувається внаслідок танення льодовиків полярного й гірського походження, а також айсбергів. Однак нині запаси прісної води викликають занепокоєння в людства. Недбале ставлення людини до природи спричиняє забруднення води різними хімічними речовинами, відходами нафтохімічних і целюлозно-паперових підприємств. Через надмірне використання мінеральних добрив, гербіцидів і пестицидів вони через ґрунт потрапляють у воду. Як наслідок цього виникають різноманітні захворювання, що викликають незворотні зміни в організмі. Отже, природна прісна вода не завжди є чистою, а прісна вода льодовиків та айсбергів практично недоступна для використання.
Важливо зазначити, що вода — основа життя на Землі. Тому для підтримки життєдіяльності свого організму кожній людині необхідно вживати 2-2,5 л чистої води на добу. Без води не обходиться жодний живий організм.
• Зробіть дослідження про вміст води в організмі людини, організмах різних тварин і рослин. Сформулюйте висновок про значення води.
Завдяки колообігу в природі загальна кількість води не змінюється, проте внаслідок господарської діяльності людини запаси прісної води зменшуються. Тому життєво необхідною потребою та обов'язком кожної людини є збереження чистоти води й боротьба із забрудненням водних ресурсів.
Вода в природних умовах перебуває ще у двох агрегатних станах: твердому та газоподібному. З курсу географії вам відомо, що на полюсах земної кулі частина запасів прісної води сконцентрована в льодовиках і на вершинах гір у твердому стані. У газоподібному стані вода міститься в атмосфері.
Перетворити воду на пару можна в побутових і лабораторних умовах.
• Назвіть умови, за яких вода перетворюється на лід і пару.
Будова молекули води. Вивчаючи в курсі хімії 8 класу будову речовини, ви ознайомилися з кристалічною структурою води, і тепер вам відомо, що вода у твердому стані має молекулярні кристалічні ґратки.
До складу молекули води Н2О входять два атоми Гідрогену й один атом Оксигену, які сполучені між собою ковалентним полярним зв'язком. Через те, що Оксиген і Гідроген утворюють по декілька ізотопів, у природі існують різновиди води, у яких наявні й важкі ізотопи цих хімічних елементів.
Будову зовнішнього енергетичного рівня атома Оксигену відображає електронна формула 2s22p4, відповідно до якої із шести електронів атома є 2s і 2р спарених і 2р — неспарених. За рахунок неспарених р-електронів атом Оксигену утворює дві спільні електронні пари із s-електронами двох атомів Гідрогену (рис. 10).

Рис. 10. Утворення спільних електронних пар у молекулі води
Кут між орбіталями, що утворили зв'язок, становить 105°. Тому молекула води має кутову будову (рис. 11).

Рис. 11. Кутова будова молекули води
Атом Оксигену, як більш електронегативний, зміщує до себе електронну густину хімічного зв'язку. Спільні електронні пари разом з електронами, які не брали участі в утворенні хімічних зв'язків, концентрують на атомі Оксигену частково негативний заряд δ- (читається «дельта мінус»). Відповідно на атомах Гідрогену зосереджений частково позитивний заряд δ+ (читається «дельта плюс»).
Отже, молекула води — це диполь (рис. 12).
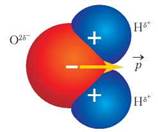
Рис. 12. Масштабна модель будови молекули води з утворенням диполя
Саме тому у вузлах кристалічних ґраток води молекули строго орієнтовані одна до одної своїми полюсами. На рисунку 12 зображено масштабну модель молекули води, де позначено часткові заряди на полюсах молекули.
• Розгляньте модель молекули води та поясніть, чому Оксиген має заряд 2δ-, а Гідроген — заряд δ+.
Водневий зв'язок. Ви знаєте, що молекули речовин утворюються внаслідок виникнення ковалентного зв'язку між однаковими або різними атомами неметалічних елементів. Проте між окремими молекулами також може утворюватися зв'язок, якщо молекули полярні.
Механізм утворення одного такого зв'язку полягає в притяганні атомів Гідрогену до атомів значно сильніших електронегативних елементів, якими є Оксиген, Флуор і Нітроген. Такий вид хімічного зв'язку називають водневим.
Водневий зв'язок — це електростатична взаємодія між молекулами за участю атомів Гідрогену.
Сила водневого зв'язку невелика, і порівняно з ковалентним він набагато слабший. Однак у різних полярних сполук він може бути більш або менш сильним. Це залежить від електронегативності атома, що зв'язаний із Гідрогеном.
Завдяки утворенню водневого зв'язку речовини асоціюють у рідинах і утворюють димери (дві молекули) або цілі агрегати молекул (рис. 13).
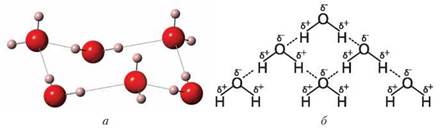
Рис. 13. Модель асоційованих молекул води (а) і схема утворення водневих зв'язків між молекулами води (б)
Водневі зв'язки позначають крапками. Це означає, що вони значно слабші за ковалентні.
Наявність водневого зв'язку, а відповідно — й асоційованих молекул, впливає на властивості речовин. Зокрема, спостерігаємо підвищення температур плавлення та кипіння. Наприклад, температура кипіння води є вищою за температуру кипіння подібних за складом до води летких сполук неметалічних елементів з Гідрогеном — H2S і H2Se. Якщо гідроген сульфід і гідроген селенід за звичайних умов є газами, то вода — рідина.
Утворення водневого зв'язку між молекулами води називають міжмолекулярним. Однак водневий зв'язок може виникати всередині молекул, тобто між атомами тієї самої молекули. Такий зв'язок називають внутрішньомолекулярним. Він властивий не тільки неорганічним речовинам, а й молекулам органічних речовин, які мають високі відносні молекулярні маси: білкам, нуклеїновим кислотам, полімерам.
Речовини, у яких наявні внутрішньомолекулярні водневі зв'язки, дещо відрізняються від тих, яким властиво утворювати міжмолекулярні зв'язки. Зокрема, вони краще розчиняються в органічних розчинниках, характеризуються більшою леткістю.
Водневий зв'язок не належить до сильних. Він легко утворюється й так само легко руйнується, що важливо для біологічних процесів, які відбуваються в живих організмах і є необхідними для їх функціонування.
Водневий зв'язок ви вивчаєте для того, щоб зрозуміти механізми процесів розчинення, електролітичної дисоціації, окисно-відновних реакцій.
Отже, завдяки своїй унікальній будові молекула води здатна утворювати агрегати за рахунок водневих зв'язків з молекулами полярних і йонами йонних сполук. Це відіграє важливу роль у процесі розчинення речовин з утворенням розчинів.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Вода — унікальна речовина, одна з найпоширеніших у природі; займає майже 71 % площі земної поверхні; входить до складу багатьох мінералів і гірських порід, а також солей, які називають кристалогідратами, тощо.
Вода заповнює створені людиною штучні водоймища: водосховища, моря, ставки.
• Властивості води зумовлені унікальною будовою її молекули. Зв'язки, що виникають між Оксигеном і Гідрогеном, ковалентні полярні, розташовані під кутом 105°. Унаслідок цього молекула стає полярною, утворюється диполь.
• Диполь — система з двох зарядів (δ- і δ+), однакових за значенням, але протилежних за знаком.
• Водневий зв'язок — електростатична взаємодія між молекулами за участю атомів Гідрогену.
• Водневий зв'язок між молекулами води називають міжмолекулярним, а зв'язок усередині однієї й тієї самої молекули між атомами (або групами атомів) — внутрішньомолекулярним.
• Така структура води відіграє важливу роль у процесі розчинення речовин з утворенням розчинів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
- 1. Поясніть поширення води в природі та її важливість для життя на Землі. Яка біологічна роль води?
- 2. Поясніть будову молекули води щодо електронної будови атомів, які входять до її складу.
- 3. Обґрунтуйте вплив водневого зв'язку на властивості речовин.
- 4. Доповніть висловлювання так, щоб вони стали завершеними.
Між атомами Оксигену й Гідрогену в молекулі води існують ... полярні ... .
Молекула води — ... сполука.
Диполь — це система з ... зарядів, ... за значеннями, але ... за знаком.
Водневий зв'язок може бути ... і ... .
ЦІКАВО ЗНАТИ
• Діаліз — очищення колоїдних розчинів і високомолекулярних речовин від розчинених у них низькомолекулярних сполук за допомогою напівпроникної мембрани. Під час діалізу молекули низькомолекулярної речовини проникають крізь мембрану, а колоїдні частинки залишаються.
Діаліз застосовують для очищення колоїдних розчинів від домішок; у промисловості — для очищення штучних волокон, а також у процесі виготовлення лікарських препаратів.
• Гемодіаліз — метод очищення крові хворих на гостру й хронічну ниркову недостатність. Під час гемодіалізу відбувається видалення з організму токсичних речовин, нормалізується водний та електролітичний баланс.
Цей контент створено завдяки Міністерству освіти і науки України
