Хімія. 8 клас. Гранкіна
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 7. Періодична система хімічних елементів з позиції теорії будови атома
За багато років роботи над Періодичною системою Д. І. Менделєєв створив, як він сам писав, природну систему елементів. Природна — це така система, в якій кожний елемент стоїть на своєму місці, що відповідає його властивостям.
Правильність розташування елементів у таблиці підтвердилася під час вивчення будови атома. Якби Д. І. Менделєєв був живий у той час, коли вчені створювали теорію будови атома, і бачив, як чудово збігається положення елемента в Періодичній системі з будовою ядер і електронних оболонок атомів цього елемента, напевно, він був би цілком щасливий.
ЕЛЕКТРОННІ РОДИНИ Й СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ
Згадаємо (або повторимо § 2), що в Періодичній системі Д. І. Менделєєва виділяють групи й періоди. У короткому варіанті Періодичної системи кожна група ділиться на головну (А) і побічну (Б) підгрупи.
Зіставимо розташування елементів у підгрупах та їхні електронні родини.
В атомах елементів, які перебувають у головних підгрупах І і ІІ груп, на зовнішньому рівні 1 або 2 електрони. Вони розташовуватимуться на орбіталі s-підрівня. Виходить, у головних (А) підгрупах І і ІІ груп розташовані s-елементи. До s-елементів належать також елементи 1-го періоду — Гідроген і Гелій.
Завдання
Знайдіть і назвіть s-елементи I (А) і ІІ (А) підгруп 2 і 3-го періодів.
Можлива відповідь: Літій, Берилій, Натрій, Магній.
Завдання
Знайдіть і назвіть будь-які три р-елементи 3-го періоду.
Можлива відповідь: Силіцій, Сульфур, Аргон.
В атомах елементів, які розташовані в головних підгрупах III—VIII груп, заповнюються орбіталі р-підрівня. Це р-елементи.
Всі елементи, які становлять побічні підгрупи, належать до d-елементів. d-елементи називають іще перехідними елементами, тому що вони ніби стоять на переході від s- до р-елементів.
Є ще хімічні елементи, в атомах яких заповнюються орбіталі f-підрівня. Їхні символи розташовані у два ряди внизу Періодичної системи (див. форзац).
— І навіщо це все вивчати? Я помітив, у таблиці клітинки із s-елементами розфарбовані в червоний колір, з р-елементами — у жовтий, з d-елементами — у синій. А внизу — зелені f-елементи! Я все знаю!
— А якщо таблиця не кольорова?
— А-а... у-у... Тоді треба вчити.
У довгоперіодному варіанті Періодичної системи простіше розібратися з електронними родинами: перші дві групи — s-елементи, потім ідуть d-елементи (тільки з 4-го періоду), і наприкінці шість груп — р-елементи. Ви можете користуватися тим варіантом таблиці, який зручніший для вас.
ДЕЯКІ ВАЖЛИВІ ПОНЯТТЯ, ЯКІ ПОВ'ЯЗУЮТЬ БУДОВУ АТОМА Й ПОЛОЖЕННЯ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ
Щоби зіставити розташування елемента в Періодичній системі та його властивості з будовою атомів цього елемента, нам потрібно знати деякі важливі поняття. Якісь із них ми вже знаємо, з іншими будемо знайомитися.
Валентні електрони
• Валентними називають електрони, які можуть брати участь в утворенні хімічних зв'язків.
Для атомів елементів 1—3-го періодів — це електрони зовнішніх (останніх) рівнів.
Валентність
Це поняття вам знайоме із 7 класу. Повторимо: валентність — це здатність атома утворювати хімічні зв'язки.
Тепер ми можемо визначити чисельне значення валентності, спираючись на будову електронної оболонки атома.
• Чисельно валентність, як правило, дорівнює кількості неспарених електронів.
Це електрони зовнішнього (останнього) рівня. Але електрони на цьому рівні можуть бути спареними й неспареними. Як це зіставити з тим, що валентність дорівнює номеру групи (як ви вивчали в 7 класі)?
Завдання
Зобразіть електронно-графічну будову зовнішнього рівня атома Оксигену.
Скільки в нього неспарених електронів? Яка валентність Оксигену?
Відповідь 1 дивіться наприкінці параграфа.
Завдання
Зобразіть електронно-графічну будову зовнішнього рівня атома Літію.
Скільки в нього неспарених електронів? Яка валентність Літію?
Відповідь 2 дивіться наприкінці параграфа.
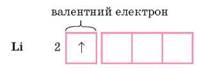
Отже, ми бачимо, що в атомі Оксигену два неспарених електрони, значить, він двовалентний. В атомі Літію один неспарений електрон. Він одновалентний. І Оксиген, і Літій проявляють постійну валентність, іншого значення валентності в них немає. Але є елементи, в яких кілька значень валентності.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Розглянемо, що відбувається в атомах елементів зі змінною валентністю. Зобразимо електронно-графічну будову зовнішнього рівня атома Фосфору.
![]()
На зовнішньому рівні три неспарених електрони. Це основний стан атома. Валентність Фосфору в основному стані дорівнює трьом.
Однак під час одержання додаткової енергії, наприклад у разі зіткнення атомів або поглинання світла, можливий перехід електрона з одного підрівня на інший у межах одного рівня:
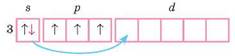
Такий процес називають промотуванням.

У промотованому стані в атомі Фосфору вже п'ять неспарених електронів, отже, він п'ятивалентний. От так і виходить, що атом має змінну валентність.
У атомі Хлору на зовнішньому рівні сім електронів, з урахуванням промотування максимальна валентність дорівнює VII.
Завдання
Визначте вищу валентність для таких елементів: S, Se, Br, Al.
Відповідь 3 дивіться наприкінці параграфа.
Оскільки число електронів на зовнішньому рівні дорівнює номеру групи, можна зробити висновок, що вища валентність також дорівнює номеру групи.
• Валентність, що дорівнює номеру групи, називають вищою валентністю.
Зверніть увагу, валентність елементів IА—IIIА підгруп постійна й дорівнює номеру групи. Для елементів зі змінною валентністю тільки одна з валентностей є вищою. В елементів Нітрогену, Оксигену, Флуору вища валентність не дорівнює номеру групи.
— Так що, треба щоразу для визначення валентності записувати будову зовнішнього рівня атома?
— Не обов'язково. Можна порахувати так: перша — вища валентність, дорівнює номеру групи, потім віднімаємо цифру 2 — одержуємо наступну валентність, потім, якщо можна, ще віднімаємо 2 і т. д.
Наприклад, для елементів IV групи можливі валентності IV і (4-2) II.
Для елементів VII групи — VII, (7-2) V, (5-2) III, (3-2) I.
ЕЛЕКТРОНЕГАТИВНІСТЬ
• Електронегативність (ЕН) — це сила, з якою атом притягує до себе електрони інших атомів.
Чим більше значення електронегативності, тим сильніше ядро притягує й утримує як власні валентні електрони, так і валентні електрони, отримані від інших, сусідніх атомів.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Хіміки оцінюють електронегативність атома, порівнюючи величини енергії, яка виділяється під час приєднання електрона до атома, і енергії, яку потрібно витратити, щоби відірвати електрон від атома. Однак найчастіше використовують більш просту величину, запропоновану Нобелівським лауреатом Лайнусом Полінгом, — відносну атомну електронегативність.
Чисельні значення електронегативності можна знайти в таблиці «Відносні електронегативності» (табл. 3).
Таблиця 3
Відносні електронегативності елементів

Приклад
Розгляньте таблицю електронегативності. Знайдіть елемент із найвищою електронегативністю. Це... Флуор. Він буде відтягувати на себе валентні електрони навіть від атома Оксигену, який, у свою чергу, посідає друге місце за величиною електронегативності. А тепер знайдіть елементи з найнижчою електронегативністю. Знайшли? Це елементи ІА групи.
Зверніть увагу, що атоми з високою електронегативністю, наприклад Флуор, Оксиген, утворюють молекули активних неметалів — фтору та кисню, а з атомів елементів із низькою електронегативністю, наприклад, ІА і IIА підгруп утворюються метали — лужні й лужноземельні. У формулах зазвичай на першому місці пишуть символ елемента з нижчою електронегативністю.
МЕТАЛІЧНІ Й НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ
Із розподілом усіх елементів на металічні й неметалічні ви знайомилися ще в 7 класі.
• Металічними називають ті елементи, атоми яких утворюють прості речовини — метали, а атоми неметалічних елементів утворюють прості речовини — неметали.
До металічних елементів належать s-елементи (крім Гідрогену й Гелію), усі d- і f-елементи, а також частина p-елементів. До неметалічних — s-елементи Гідроген і Гелій і частина p-елементів.
Як же визначити, де в Періодичній системі металічні й неметалічні елементи? Треба провести діагональ від Бору до Астату. Це зручно зробити в довгому варіанті Періодичної системи. Елементи, які перебувають на цій прямій і правіше, — неметалічні елементи, елементи, розташовані лівіше, — металічні (табл. 4, 5).
Таблиця 4
Розташування металічних і неметалічних елементів у Періодичній системі Д. І. Менделєєва (довгий варіант)

Таблиця 5
Розташування металічних і неметалічних елементів у Періодичній системі Д. І. Менделєєва (короткий варіант)

• Порівнюючи електронегативності елементів, ми бачимо, що металічні елементи легше віддають електрони під час утворення сполук з атомами інших елементів, а неметалічні елементи активніше електрони забирають. Це досить умовно, але слід запам'ятати. Тому прийнято вважати, що зі збільшенням електронегативності неметалічні властивості елементів підсилюються, а металічні властивості слабшають.
ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1. Електронно-графічна будова зовнішнього рівня атома Оксигену:

Відповідь 2. Електронно-графічна будова зовнішнього рівня атома Літію:
Відповідь 3. Вища валентність елемента дорівнює номеру групи, в якій він розміщений. Таким чином з'ясовуємо, що Сульфур розташований у VI групі, відповідно, його вища валентність — VI. Селен також у VI групі, отже, його вища валентність така ж сама — VI. Бром розміщений у VII групі, відповідно, він має вищу валентність VII. Щодо Алюмінію, то його група — III і вища валентність теж III. У цього елемента тільки одне значення валентності.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
- 1. В яких групах і підгрупах у Періодичній системі перебувають s-елементи? p-елементи? d-елементи?
- 2. Укажіть, де в Періодичній системі розташовані елементи з постійною валентністю? зі змінною валентністю?
- 3. Які елементи називають металічними? неметалічними?
- 4. Визначте, як змінюється електронегативність елементів у группах? у періодах?
- 5. Які електрони називають валентними?
- 6. Чому чисельно дорівнює валентність?
- 7. Яке значення валентності називають вищою валентністю?
- 8. Що таке електронегативність? Назвіть елементи з найбільшою та найменшою електронегативністю.
- 9. Як можна визначити металічні й неметалічні елементи, застосовуючи поняття електронегативності?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Виберіть окремо символи s-елементів і p-елементів:
Na, K, Cl, H, S, Be, Cs, Se, Sn, He.
2. Виберіть окремо елементи з постійною та змінною валентністю:
Калій, Бор, Нітроген, Бром, Рубідій, Стронцій, Селен, Германій.
3. Визначте валентність атома Карбону. Підтвердьте свою відповідь електронно-графічною формулою.
4. Елемент у різних сполуках проявляє валентність, що дорівнює VII, V, III і I. Який це може бути елемент?
5. Визначте валентності в атомів:
- Селену,
- Силіцію,
- Йоду,
- Арсену
6. Атом елемента має таку будову зовнішнього рівня:
...3s23p3.
Виберіть правильну відповідь з назвою елемента і валентністю.
- а) Al, III;
- б) N, IV, II;
- в) As, III;
- г) P, III, V.
7. На зовнішньому рівні атома сім валентних електронів. Яка електронна формула може бути в цього атома?
- а) 3s23p5;
- б) 3s23p1;
- в) 2s22p4;
- г) 3s23p6.
8. Укажіть можливу валентність Сульфуру у сполуках?
- а) II, III, IV;
- б) I, II, III;
- в) VI, IV, II;
- г) III, V, VII.
9. Укажіть кількість валентних електронів у атомі Нітрогену:
- а) 5;
- б) 7;
- в) 10;
- г) 3.
Цей контент створено завдяки Міністерству освіти і науки України
