Фізика і астрономія. Профільний рівень. 11 клас. Засєкіна
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 44. Випромінювання
Енергетичні рівні атома Гідрогену. Згідно з постулатами Бора перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням або поглинанням фотонів, енергію яких hv визначають за формулою hv = Ek - En, або ![]() де k і n — цілі числа (номери стаціонарних станів).
де k і n — цілі числа (номери стаціонарних станів).
Для наочності прийнято зображати значення енергій атомів у вигляді горизонтальних прямих, розташованих одна над одною на відстані, пропорційній різниці їх енергій. Найнижча пряма відповідає нормальному стану атома.
На малюнку 194, с. 222 зображено схему рівнів енергії атома Гідрогену.
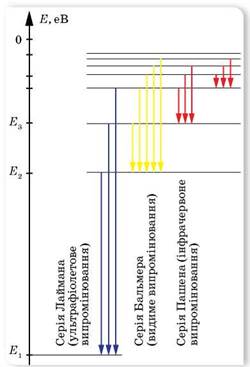
Мал. 194. Енергетичні рівні в атомі Гідрогену
Енергію електрона, що покинув атом (міститься на нескінченній відстані від ядра), приймають за нуль. Зрозуміло, що в цьому разі енергія будь-якого електрона, який перебуває ближче до ядра, буде меншою, а отже, від'ємною. У нормальному (не збудженому) стані енергія атома буде мінімальною й у випадку атома Гідрогену її значення Е1 = -13,55 еВ. У першому збудженому стані (другий енергетичний рівень) атом Гідрогену матиме енергію Е2 = -3,38 еВ, у другому — Е3 = -1,5 еВ.
З основного стану в збуджений атом може перейти, отримавши ззовні в будь-який спосіб (наприклад, поглинувши фотон або зіткнувшись з іншим атомом) порцію енергії, яка дорівнює різниці енергії стаціонарних рівнів. Так, у випадку Гідрогену атом може перейти у збуджений стан, поглинувши енергію: Е2 - Е1 = 10,17 еВ, або Е3 - Е1 = 12,05 еВ і т.д.
У збудженому стані електрон не може перебувати тривалий час. Під час переходів на перший рівень (n = 1) із другого, третього й т. д. випромінюються ультрафіолетові промені (серія Лаймана), під час переходів на другий рівень з вищих рівнів — випромінювання оптичного діапазону (серія Бальмера) й під час переходів на третій рівень — інфрачервоне випромінювання (серія Пашена). Серії названо на честь учених, які їх відкрили.

1 У деяких навчальних посібниках можна зустріти й такий запис формули Бальмера:
![]()
Річ у тім, що такий вигляд формули використовують у спектроскопії, коли спектральні лінії характеризують не частотою, а величиною, оберненою довжині хвилі. Звертаємо вашу увагу на те, що стала величина в обох випадках позначається однаково, але вона має різне значення. У даному разі R = 1,1 · 107 м-1.
Види спектрів. Отримані в такий спосіб випромінювання притаманні одноатомним газам. Спостерігають їх за допомогою спеціальних приладів — спектроскопів. А найвужчі лінії різних кольорів, що дістають під час світіння газів (або пари), називають лінійчатим спектром випромінювання.
Спектральний склад випромінювання різних речовин досить різноманітний. Проте всі спектри можна поділити на три групи: лінійчаті, смугасті та неперервні.
Лінійчатий спектр — це оптичне випромінювання поодиноких збуджених атомів, яке виникає завдяки квантовим переходам між електронними рівнями енергії (атомні спектри).
Лінійчаті спектри випромінюють усі речовини в газоподібному атомарному (але не молекулярному) стані, причому кожний хімічний елемент дає свій лінійчатий спектр, який не збігається зі спектрами інших елементів (мал. 195, а).

Мал. 195. Лінійчаті спектри випромінювання та поглинання
Головна властивість лінійчатих спектрів полягає в тому, що довжини хвиль (або частоти) лінійчатого спектра якої-небудь речовини залежать лише від властивостей атомів цієї речовини й зовсім не залежать від способу збудження світіння атомів.
Виняткову сталість частот випромінювання атомів було використано для визначення еталону основної одиниці часу — секунди. Для цього було взято одну із частот випромінювання атомів Цезію-133 і секунду означили як інтервал часу, протягом якого здійснюється певна кількість коливань (9 192 631 770), що відповідає цій частоті.
Поглинання світла речовинами також залежить від його довжини хвилі. Уперше такі дослідження провів у 1854 р. Густав Кірхгоф, який установив, що будь-яка речовина поглинає переважно промені такої довжини хвилі, які сама може випромінювати. Пояснення спектрів поглинання випливає з постулатів Бора. Лінійчаті спектри поглинання мають вигляд темних ліній на фоні неперервної райдуги, розташування яких збігається з розташуванням кольорових ліній у спектрі випромінювання даного газу (мал. 195, б; с. 223).
Смугастий спектр має вигляд кольорових смуг, розділених темними проміжками (молекулярні спектри).
Утворення молекули з атомів змінює енергетичні рівні зовнішніх електронів, оскільки в молекулі вони взаємодіють один з одним. До того ж, виникають додаткові рівні, що відповідають коливанням атомів й обертанню молекули як цілого. Енергетичні рівні коливального та обертального рухів також квантовані. Таким чином, кожний атомний рівень розчіплюється на низку близьких рівнів. У результаті переходів між цими рівнями й виникає сукупність ліній, що утворює смугу.
У неперервному спектрі немає темних проміжків, і на екрані спектрального апарата можна побачити суцільну різнокольорову смугу. Це означає, що в спектрі наявні всі довжини хвиль.
Неперервний спектр випромінюють розжарені тверді тіла й розігріті рідини, які перебувають за даної температури у стані термодинамічної рівноваги з випромінюванням. Гази під високим тиском теж можуть випромінювати неперервний спектр. Ця обставина свідчить про те, що існування неперервного спектра зумовлене не тільки властивостями окремих випромінюючих атомів, а й значно залежить від взаємодії атомів між собою.
Про рентгенівське, теплове та люмінесцентне, а також спонтанне й вимушене випромінювання читайте в електронному додатку.

ЗНАЮ, ВМІЮ, РОЗУМІЮ
1. Зобразіть за допомогою схеми енергетичних рівнів атома Гідрогену перехід, який відповідає випромінюванню ультрафіолетових променів. 2. За яким принципом спектральні лінії Гідрогену об'єднано в серії? 3. Які речовини дають суцільний спектр? Які — лінійчатий? 4. Чим відрізняються лінійчаті спектри різних газів і пари?
Цей контент створено завдяки Міністерству освіти і науки України
