Фізика. Рівень стандарту. 10 клас. Сиротюк
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 43. Необоротність теплових процесів. Ентропія
Термодинамічний підхід не дає змоги розкрити внутрішню природу необоротності реальних процесів у макроскопічних системах. Він тільки фіксує факт необоротності у другому законі термодинаміки, спираючись на експеримент. Молекулярно-кінетичний підхід дає змогу проаналізувати причини такої необоротності реальних процесів і певної спрямованості енергетичних перетворень у природі.
Розглянемо з точки зору молекулярно-кінетичної теорії модель гіпотетичного «вічного» двигуна другого роду (мал. 108).
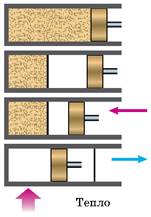
Мал. 108. Один з варіантів «вічного» двигуна другого роду
Припустимо, що цей «вічний» двигун працює так: газ самовільно збирається в лівій половині циліндра, після чого поршень посуваємо впритул до газу. За такого переміщення зовнішні сили роботи не виконують, оскільки зібраний у лівій половині газ не чинить тиску на поршень. Потім підводимо до газу тепло і примушуємо його ізотермічно розширюватися до попереднього об’єму. При цьому газ виконує роботу за рахунок тепла, що підводиться. Після того як поршень перейде у крайнє праве положення, чекатимемо, поки газ знову збереться самовільно в лівій половині посудини, і потім повторюємо все знову. У результаті вийшла періодично діюча машина, яка виконує роботу тільки за рахунок отримання тепла від навколишнього середовища.
Молекулярно-кінетична теорія дає змогу одразу пояснити, чому такий пристрій не працюватиме. Вірогідність того, що газ, який містить велике число молекул, хоч би один раз самовільно зібрався в одній половині посудини, нікчемно мала. І вже абсолютно неможливо уявити, щоб це могло періодично повторюватися в ході роботи машини.
Тепер можна вказати зміст необоротного процесу: процес є необоротним, якщо зворотний процес насправді майже ніколи не відбувається. Він малоймовірний, щоб його можна було спостерігати на досліді. Так, цей приклад ґрунтувався на процесі мимовільної концентрації газу в одній половині посудини. Такий процес є зворотним до процесу розширення газу в порожнечу. А це є одним з найяскравіших прикладів необоротних процесів - зворотний процес у макроскопічній системі ніколи не спостерігався.
Отже, з точки зору уявлень молекулярно-кінетичної теорії, другий закон термодинаміки стверджує те, що у природі в макроскопічних системах процеси розвиваються в напрямку, коли менш імовірні стани системи замінюються на більш імовірні. Таку інтерпретацію другого закону термодинаміки вперше запропонував Людвіг Больцман. У випадку відхилення від середнього значення густини ідеального газу було з’ясовано, що стани газу, при яких розподіл молекул близький до рівномірного, трапляються набагато частіше, ніж далекі від рівноваги стани із сильно нерівномірним розподілом молекул.
Можна сказати, що необоротний перехід до рівноваги - це перехід від більш упорядкованих нерівноважних станів до менш упорядкованих, хаотичних станів. Під час розширення газу в порожнечу початковий стан, коли газ займає частину наданого йому об’єму, є значною мірою впорядкованим, тоді як кінцевий стан теплової рівноваги, коли газ рівномірно розподілений в усьому об’ємі посудини, є абсолютно невпорядкованим.
Коли тіло отримує деяку кількість теплоти за рахунок виконання механічної роботи, то це означає необоротне перетворення кінетичної енергії впорядкованого макроскопічного руху на кінетичну енергію хаотичного руху молекул. Перетворення тепла в роботу, навпаки, означає перетворення енергії безладного руху молекул в енергію впорядкованого руху макроскопічного тіла - такий перехід, як ми бачили, у принципі можливий, але малоймовірний.
Необоротний характер процесів переходу у стан теплової рівноваги, встановлюваний другим законом термодинаміки, справджується тільки для великих макроскопічних систем.
У системах з невеликим числом частинок самовільне відхилення якої-небудь величини від її середнього значення можуть бути порівняні із середнім значенням. Така система часто самовільно виходить зі стану рівноваги, і другий закон термодинаміки тут не застосовується (мал. 109). Характерний приклад порушення другого закону термодинаміки в достатньо малих системах - броунівський рух, при якому зависла в рідині частинка отримує кінетичну енергію від молекул навколишнього середовища, хоча температура середовища не вища від температури броунівської частинки.

Мал. 109. Ілюстрація самовільного нерівноважного процесу в ізольованій системі
Для опису термодинамічної системи використовують фізичну величину, що отримала назву ентропія і яка є однією з основних термодинамічних величин.
Ентропія - фізична величина, яка в спостережуваних явищах і процесах характеризує розсіювання енергії, зумовлене перетворенням усіх її видів на теплову і рівномірним розподілом тепла між тілами (вирівнювання їх температур).
Ентропію використовують для опису термічних явищ і термічних властивостей макроскопічних об’єктів.
Нерівноважні процеси в ізольованій системі супроводжуються зростанням ентропії, вони наближають систему до стану рівноваги, у якому ентропія максимальна. Поняття ентропії у 1865 р. увів Рудольф Клаузіус.
Серед величин, що визначають стан системи, ентропія займає особливе місце. Вона виділяється своєю абстрактністю, фізичний зміст її не випливає безпосередньо з математичного виразу і не піддається простому інтуїтивному уявленню. Він може бути з’ясований під час розгляду різних необоротних фізичних, хімічних, ядерних, біологічних та інших процесів, наприклад: тертя, електронагрівання, нерівноважний теплообмін, дифузія, дисипація (розсіювання) енергії.
Ентропія є величиною, яка залежить від маси і об’єму системи, тому сумарна ентропія двох систем: S = S1 + S2. Ентропія є функцією стану системи, її зміна не залежить від способу переходу з кінцевого стану в початковий: ΔS = Sf - Si, якщо обидва стани рівноважні.
У самочинних процесах, які протікають в ізольованій системі, ентропія зростає (ΔS > 0). Ця властивість є основою другого закону термодинаміки. Виходячи з означення ентропії за Больцманом, у самочинних процесах в ізольованій системі безладдя завжди зростає. Загалом, для довільної, не обов’язково ізольованої термодинамічної системи:
ΔS > ΔQ/T,
де рівність виконується, за означенням, для рівноважних оборотних процесів.
Ентропія залишається сталою при рівноважних оборотних процесах в ізольованій системі, яка не обмінюється ні енергією, ні частинками з іншими системами. У неізольованих термодинамічних системах зміна ентропії підпорядкована першому закону термодинаміки. Процеси, що відбуваються зі сталою ентропією називають ізоентропійними.
Серед рівноважних процесів до таких належить адіабатний процес. Ізоентропійними також можуть бути деякі нерівноважні процеси.
ЧИ ЗНАЄТЕ ВИ, ЩО...
• Ентропія - абстрактна величина, фізичний зміст її не випливає з математичного виразу і не піддається інтуїтивному уявленню. Були численні спроби уточнити фізичний зміст ентропії, які ґрунтувалися на пошуках аналогій з іншими величинами, доступнішими безпосередньому сприйняттю. Наприклад, якщо уявити елементарну роботу як добуток сили й елементарного переміщення, то робота - аналог кількості тепла, сила - аналог абсолютної температури, а переміщення - аналог ентропії. В іншому варіанті елементарна робота може бути представлена добутком тиску й елементарного об’єму. Тут аналогом ентропії буде об’єм. Такі порівняння штучні, і їх користь для інтерпретації ентропії дуже сумнівна, оскільки неможлива аналогія ентропії з теплоємністю тіла.
ЗАПИТАННЯ ДО ВИВЧЕНОГО
- 1. У чому полягає зміст необоротності теплових процесів?
- 2. Як довести, що теплові процеси у природі є необоротними?
- 3. Що таке ентропія? Хто вперше ввів це поняття?
- 4. Що доводить ентропія?
Цей контент створено завдяки Міністерству освіти і науки України
