Хімія. 9 клас. Гранкіна
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 27. ЕТАНОВА (ОЦТОВА) КИСЛОТА
— Неспілі фрукти, щавель, барбарис, журавлина, лимон... Що спільного між ними?
— Усе зрозуміло: вони кислі.
— А от обумовлений кислий смак плодів і листків багатьох рослин різними карбоновими кислотами — речовинами, до складу яких входить одна або декілька карбоксильних груп -СООН.
Етанова кислота належить до карбонових кислот. До складу етанової кислоти входить карбоксильна група:
![]()
Скорочено її записують як -COOH.
Етанова кислота має у своєму складі два атоми Карбону, як і етан, тому вона має таку назву. Один із цих атомів входить до складу карбоксильної групи. Формула кислоти така:

Молекулярна формула — CH3COOH.
Зверніть увагу, що із чотирьох атомів Гідрогену, які містяться в молекулі етанової кислоти CH3COOH, тільки один, що входить у карбоксильну групу -COOH, здатний відщеплюватися у вигляді катіона H+, тому етанова кислота одноосновна.
У стародавніх греків уявлення про кислий смак було пов'язано насамперед з оцтом — розчином оцтової кислоти, яка утворюється під час скисання вина. Саме слово «оцет», або, як говорили жителі Еллади, «оксис», означало «кислий».
У зв'язку з тим, що багато карбонових кислот було відкрито задовго до прийняття правил міжнародної номенклатури, більшість із них мають тривіальні, історично сформовані назви. Етанову кислоту називають оцтовою кислотою, а метанову — мурашиною.
Дізнайтеся більше
Мурашина кислота
У самок і робочих мурах у черевцях є отруйні залози, що виробляють кислоту. У лісової мурахи її приблизно 5 мг. Кислота служить комасі зброєю для захисту і нападу. Навряд чи знайдеться людина, яка не зазнала її укусів.
Мурашина (метанова) кислота НСООН викликає хімічні опіки на шкірі. Вона також міститься у деяких рослинах (наприклад, у листках кропиви), входить до складу отрути бджіл, ос.
Щоби зменшити відчуття печіння в разі укусу бджоли, оси, опіку кропиви, треба цю кислоту нейтралізувати. Тому уражене місце потрібно швидко протерти розчином нашатирного спирту (амоній гідроксиду). Він має лужне середовище.
ФІЗИЧНІ ВЛАСТИВОСТІ ЕТАНОВОЇ КИСЛОТИ
Етанова (оцтова) кислота — за кімнатної температури безбарвна рідина з різким характерним запахом. За температури нижче +17 °С (температура плавлення) кристалізується й стає схожою на лід, тому її називають «крижаною» оцтовою кислотою.
Температура кипіння етанової кислоти — +118 °С. У воді вона розчиняється в будь-яких співвідношеннях. Розчин із масовою часткою кислоти 3-9% називають столовим оцтом, 70-80% — оцтовою есенцією.
ХІМІЧНІ ВЛАСТИВОСТІ
Хімічні властивості етанової кислоти можна розділити на дві групи:
1) такі самі, як і в неорганічних кислот,
2) характерні тільки для органічних кислот.
Більш докладно властивості карбонових кислот ви будете вивчати у старших класах. Ми зараз розглянемо тільки властивості, подібні до неорганічних кислот.
• Згадайте властивості неорганічних кислот.
- 1. Дисоціація у водних розчинах
Дослід «Вплив етанової кислоти на індикатори»
У дві пробірки наллємо по 1-2 мл розчину етанової кислоти й додамо в одну декілька крапель розчину фіолетового лакмусу, в іншу — метилового оранжевого. Що спостерігаємо? Забарвлення індикаторів змінилося на червоне.

Причина зміни забарвлення індикаторів у розчині етанової кислоти та сама, що й у розчинах неорганічних кислот: наявність йонів Гідрогену, які утворюються під час дисоціації її молекул:
CH3COOH ⇄ CH3COO- + H+
• Кислотний залишок CH3COO- називається етаноат (ацетат)- іоном.
• Нагадаємо, що в розчинах кислот індикатори лакмус, метиловий оранжевий, універсальний стають червоними. Фенолфталеїн забарвлення не змінює.
Етанова кислота — слабкий електроліт.
- 2. Взаємодія з основами
Дослід «Взаємодія етанової кислоти з лугом»
У пробірку наллємо 1-2 мл розчину лугу й додамо декілька крапель розчину фенолфталеїну. Потім по краплях будемо додавати розчин етанової кислоти до знебарвлення розчину.

Чому відбувається знебарвлення розчину?
Етанова кислота взаємодіє з основами. При цьому утворюються сіль натрій етаноат і вода:
![]()
Або в молекулярній формі:
![]()
- 3. Взаємодія з основними оксидами
Основні оксиди взаємодіють з етановою кислотою з утворенням солі й води:

Дослід «Взаємодія етанової кислоти з основним оксидом»
У пробірку наллємо 1-2 мл розчину етанової кислоти й додамо невелику кількість порошкоподібного кальцій оксиду. Чому відбувається розчинення оксиду?
- 4. Взаємодія з металами
Дослід «Взаємодія етанової кислоти з металами»
У дві пробірки наллємо по 1-2 мл розчину етанової й хлоридної кислот. В обидві пробірки помістіть небагато порошку магнію або магнієвої стружки.

Порівняйте активність взаємодії цих кислот з магнієм за інтенсивністю виділення газу.
Активні метали витісняють із етанової кислоти водень. При цьому утворюється ще й сіль, у цьому випадку — магній етаноат:
![]()
- 5. Взаємодія із солями більш слабких кислот
Витиснення більш слабкої карбонатної кислоти етановою ви можете спостерігати, якщо крапнете розчином етанової кислоти на питну соду.
Відбувається така реакція:
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2↑
Здійсніть цей дослід удома.
Дізнайтеся більше
Оцтову й лимонну кислоти можна використовувати для усунення накипу з побутових виробів. Накип складається переважно з карбонатів Кальцію й Магнію, тому він розчиняється в кислотах.
Органічні кислоти у природі
У щавлі, а також у ревені, кислиці, шпинаті міститься щавлева кислота HOOC-COOH. Багато карбонових кислот, наприклад яблучна, винна, лимонна, хінна, утворюються у вакуолях клітин плодів під час часткового окиснення глюкози й у результаті деяких інших біохімічних процесів (рис. 74). Плоди цитрусових багаті на лимонну кислоту: у м'якоті апельсина її близько 2 %, у грейпфруті — до 3 %, а в лимоні — 6 %. Тому не дивно, що вперше вона була виділена К. Шеєле 1784 р. саме з лимонів.

Рис. 74. Органічні кислоти у природі
ЗАСТОСУВАННЯ ЕТАНОВОЇ КИСЛОТИ
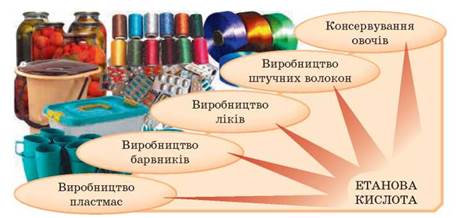
Рис. 75. Сфери застосування етанової кислоти
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Під час виконання дослідів дотримуйтеся правил безпеки! Просимо допомоги батьків!
Розпізнаємо розчини кухонної солі, питної соди й оцту
Перед виконанням досліду попросіть батьків або друзів приготувати в підписаних одноразових стаканчиках № 1, 2, 3 розчини кухонної солі, питної соди й оцту.
Запропонуйте хід експерименту й розпізнайте ці розчини. Правильність розпізнавання нехай оцінять ваші помічники.
Підсумок:

ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
- 372. Які речовини називають карбоновими кислотами?
- 373. Опишіть фізичні властивості етанової кислоти.
- 374. Як змінює забарвлення індикаторів водний розчин етанової кислоти? Чому?
- 375. Розкажіть, які властивості етанової кислоти є спільними з неорганічними кислотами.
- 376. Де застосовують оцтову кислоту?
- 377. Який розчин має назву «оцтова есенція»?
- 378. Яка кислота має наву «крижана» і чому?
ВИКОНАЙТЕ ЗАВДАННЯ
379. Напишіть рівняння реакції горіння етанової кислоти в надлишку кисню з урахуванням того, що в результаті реакції утворюються вуглекислий газ і вода. Складіть рівняння реакцій оцтової кислоти з такими речовинами:
- а) калієм;
- б) кальцієм;
- в) купрум(ІІ) оксидом;
- г) кальцій карбонатом;
- д) калій гідроксидом.
380. Чому оцтова кислота реагує з кальцій карбонатом, а з кальцій сульфатом — ні?
381. Визначте масову частку Оксигену в етановій кислоті.
382. Унаслідок взаємодії етанової кислоти з магнієм виділилося 11,2 л газу (н. у.). Визначте масу кислоти, що прореагувала.
383. Визначте масу етанової кислоти, що міститься у 500 г столового оцту з масовою часткою кислоти 9 %.
384. Потрібно видалити накип у чайнику. Маса накипу — 50 г. Визначте масу столового оцту з масовою часткою кислоти 9%, необхідної для цього. Вважайте, що в накипі міститься тільки кальцій карбонат.
385. У пробірках без підписів містяться речовини: гліцерол, етанол і етанова кислота. Як з допомогою хімічних реактивів визначити їх?
386. Яка маса крейди з масовою часткою СаСО3 96 % необхідна для нейтралізації оцтової кислоти масою 60 г?
Для допитливих
387. У чому особливості будови насичених одноосновних карбонових кислот?
388. Як утворюються назви карбонових кислот?
389. На нейтралізацію 1,2 г одноосновної карбонової кислоти витратили розчин натрій гідроксиду масою 20 г з масовою часткою NaOH 4 %. Визначте молярну масу кислоти.
390. Визначте молекулярну формулу речовини, яка складається з 54,4 % Карбону, 36,4 % Оксигену й 9,1 % Гідрогену. Густина за воднем цієї речовини дорівнює 44.
391. Скільки молекул оцтової кислоти міститься у 200 г столового оцту з масовою часткою етанової кислоти 9 %?
392. Потрібно з оцтової есенції отримати столовий оцет. Масова частка етанової кислоти в есенції дорівнює 80 %. Розрахуйте масу води, яку при цьому слід додати до 100 г есенції.
393. До оцтової есенції масою 250 г з масовою часткою етанової кислоти 80 % додали 300 г води. Обчисліть масову частку кислоти в отриманому розчині.
394. «Кислота і молодість»
Деяка одноосновна карбонова кислота використовується людством ще з античних часів. Здавна її добували зі скислого вина. Якщо дослівно перекласти назву цієї кислоти з грецької, отримаємо слово «кислий».
Пізніше цю кислоту навчилися синтезувати за допомогою сухої перегонки деревини. Цариця Єгипту Клеопатра розчиняла в цій кислоті перлини. Цариця вірила, що цей напій зберігає молодість і красу.
Під час взаємодії 30 мл розчину цієї кислоти (ω = 38,8 %, ρ = 1,03 г/мл) з надлишком калій гідрогенкарбонату виділилося 4,48 л газу. Визначте будову кислоти.
Який «коктейль» пила Клеопатра?
Напишіть рівняння реакції взаємодії основної складової перлів з цією кислотою.
Цей контент створено завдяки Міністерству освіти і науки України
