Хімія. Поглиблений рівень. 9 клас. Бутенко
Цей підручник можна завантажити у PDF форматі на сайті тут.
§ 40. Залежність швидкості хімічної реакції від температури і природи реагуючих речовин
У цьому параграфі ви дізнаєтеся:
- як залежить швидкість хімічної реакції від температури;
- як впливає на швидкість реакції природа реагуючих речовин.
Залежність швидкості реакції від температури. Чи впливає температура реакційного середовища на швидкість реакції? З підвищенням температури загальна частота зіткнень частинок реагентів зростає. Збільшується і частота ефективних зіткнень, які спричиняють перетворення речовин, отже, зростає і швидкість реакції. На рис. 33 проілюстровано вплив температури на швидкість реакції.

Рис. 33. Вплив температури (за однакової концентрації реагентів) на швидкість реакції: а — за нижчої температури кількість зіткнень частинок невелика, швидкість реакції мала; б — за підвищеної температури кількість зіткнень вища і швидкість реакції зростає
Проведемо реакцію за різних температур.
Демонстраційний дослід
Залежність швидкості хімічної реакції від температури
У чотири пронумеровані пробірки 1, 2, 3 і 4 наливають по 4 мл розчину сульфатної кислоти концентрацією 1 моль/л, на чотирьох окремих папірцях 1а, 2а, 3а, 4а зважують по 0,1 г порошкоподібного купрум(ІІ) оксиду. Пробірки 1, 2, 3, 4 ставлять в стакан з водою. Через 5 хв вимірюють температуру води в стакані. Виймають із води пробірку 1 і всипають до неї, перемішуючи, порцію купрум(ІІ) оксиду з папірця 1 а, фіксують час від моменту змішування до появи ледь помітного блакитно-синього забарвлення розчину.
Нагрівають стакан з водою на 10 °С більше від первісної температури і проводять аналогічний дослід з розчином 2 і порцією купрум(ІІ) оксиду з папірця 2а. Розчин у пробірці 3, нагрітий до температури, на 10 °С вищої за температуру розчину в пробірці 2, змішують з порцією CuO на папірці 3а. Нарешті, підігрівши в стакані з водою розчин H2SO4 в пробірці 4 ще на 10 °С, проводять дослід з порцією, зваженою на папірці 4а.
Отримані результати записують у таблицю.
|
№ пробірки |
Температура досліду, °С |
Час t, с |
Швидкість реакції, V = 100/ t |
|
1 2 3 4 |
Залежність швидкості реакції від температури наближено виражають емпіричним правилом Вант-Гоффа:
з підвищенням температури на кожні 10 градусів швидкість більшості хімічних реакцій зростає у два-чотири рази:
![]()
де Vt1 і Vt2 — швидкості реакції за температур t1 і t2;
γ — температурний коефіцієнт швидкості реакції.
Вплив природи реагуючих речовин на швидкість хімічних реакцій можна продемонструвати на прикладах взаємодії кисню з нітроген(ІІ) оксидом і карбон(ІІ) оксидом:
O2 + 2NO = 2NO2
O2 + 2CO = 2CO2
За кімнатної температури нітроген(ІІ) оксид з досить великою швидкістю взаємодіє з киснем повітря, перетворюючись на нітроген(IV) оксид. Карбон(ІІ) оксид, навпаки, за тих самих умов з киснем не взаємодіє.
Демонстраційний дослід
Залежність швидкості хімічної реакції від природи реагуючих речовин
Дослід проводять на приладі, зібраному, як показано на рис. 34.
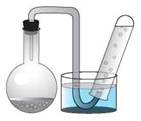
Рис. 34. Прилад для збирання газу
Наливають воду в скляний кристалізатор і наповнюють пробірку доверху водою. Закривають отвір пробірки пальцем, перевертають її вверх дном і занурюють у кристалізатор. Під водою обережно, щоб не вилилася вода й не потрапило повітря, відкривають пробірку. Колбу закріплюють у штативі й наливають у неї на 3/4 об'єму хлоридну кислоту концентрацією 1 моль/л. Два-три шматочки цинку промивають водою, витирають фільтрувальним папером і занурюють у колбу з кислотою. Закривають колбу пробкою з відвідною трубкою, кінець якої занурюють у кристалізатор з водою та підводять під отвір пробірки. За допомогою секундоміра фіксують час заповнення пробірки воднем. Після закінчення досліду виливають хлоридну кислоту з колби, промивають шматочки цинку та висушують його фільтрувальним папером.
Аналогічний дослід проводять зі шматочками олова. Знову наливають у колбу на 3/4 об'єму хлоридну кислоту тієї самої концентрації 1 моль/л. Повторюють першу частину досліду та визначають час заповнення пробірки газом.
Запишемо рівняння реакцій взаємодії цинку та олова з хлоридною кислотою:
Zn + 2HCl = ZnCl2 + H2↑
Sn + 2HCl = SnCl2 + H2↑
Чим можна пояснити різну швидкість реакцій виділення водню в першому та другому дослідах?
Основні поняття теорії активації. Точніше визначити залежність швидкості хімічної реакції від температури стало можливим лише з появою теорії активації. Згідно із цією теорією хімічна взаємодія між частинками (атомами, йонами, молекулами) речовин, які контактують, відбувається, тільки тоді, коли ці частинки досягають певного енергетичного рівня, характерного для перебігу цієї реакції, тобто її енергетичного бар'єру. Якщо вважати такі частинки активними, то саме між ними відбуваються ефективні зіткнення (рис. 35).

Рис. 35. Зіткнення частинок: а — неефективне (енергії недостатньо, щоб розірвати зв'язки А—А і В—В); б — ефективне (енергії достатньо, щоб розірвати зв'язки А—А і В—В)
Усі частинки в системі, запас енергії яких не нижчий за енергетичний бар'єр реакції, перебувають в особливому стані, який називають перехідним, або станом активованого комплексу. Вважають, що коли система перебуває в стані активованого комплексу, то в ній вже немає вихідних речовин, але ще немає і продуктів реакції.
Розглянемо це на прикладі синтезу гідроген йодиду, який здійснюється через утворення такого активованого комплексу. Під час взаємодії активних молекул H2 і I2 спочатку утворюється проміжна сполука H2...I2 (активований комплекс). Саме у цьому комплексі розриваються зв'язки H—H і I—I та утворюються нові зв'язки H—I:

Якщо вважати середній рівень енергії частинок вихідних речовин у системі таким, що дорівнює Ев, а середню енергію перехідного стану — Еп. с, то різниця Еп. с - Ев = Еа виражатиме енергію активації цієї реакції.
Енергія активації Еа — це енергія, необхідна для збудження атомів, йонів або молекул до енергії активованого комплексу.
Зміну енергії системи реагентів H2 + I2 під час їхнього перетворення на гідроген йодид HI у процесі екзотермічної реакції графічно подано на рис. 36.

Рис. 36. Енергетична діаграма екзотермічної реакції (ΔE < 0) взаємодії молекул водню та йоду
Як видно з рисунка, енергія активації реакції Еа менша за енергію дисоціації Едис вихідних молекул на вільні атоми. Отже, перебіг реакції через утворення активованого комплексу енергетично вигідніший, ніж перебіг реакції через повний розрив зв'язків у вихідних молекулах з утворенням вільних атомів. Видно, що продукти реакції мають менший запас енергії, ніж вихідні речовини, і тому реакція Н2+ І2 = 2НІ екзотермічна.
Більшість хімічних реакцій відбувається через стадію утворення проміжних активованих комплексів, енергія їхнього утворення є енергією активації. Якби енергія активації для всіх реакцій дорівнювала нулю, то в природі відбувалося б безліч хімічних реакцій. Так, вугілля і нафта в разі контакту з повітрям загорілися б, складова повітря — азот і вода утворили б розчин нітратної кислоти, а живі клітини зруйнувалися б унаслідок гідролізу.
Основні поняття. Правило Вант-Гоффа. Енергетичний бар'єр. Активований комплекс. Енергія активації.

Якоб Гендрік Вант-Гофф (1850-1911)
Видатний голландський учений, фізик і хімік. У 1901 р. одержав Нобелівську премію з хімії. Це була перша Нобелівська премія з хімії. Вант-Гофф дійшов висновку, що в атомі Карбону всі його чотири валентності направлені до вершин тетраедра. Якщо в молекулі атом Карбону сполучений із чотирма різними атомами або групами атомів, то тетраедр стає асиметричним. Так хімія отримала третій вимір. У «Нарисах з хімічної динаміки» вчений сформулював основні постулати хімічної кінетики, за якими розведені розчини підпорядковуються газовим законам.
Запитання та завдання
- °1. На яких прикладах можна показати вплив природи речовин, що реагують, на швидкість хімічної реакції?
- °2. У чому полягає суть емпіричного правила Вант-Гоффа? Як його можна виразити математично?
- °3. Що таке енергетичний бар'єр частинок реагуючих між собою хімічних речовин?
- °4. Який стан реагуючих між собою частинок називають активованим комплексом?
- 5. Що таке енергія активації будь-якої хімічної реакції?
- 6. У якому ряду метали розташовані в порядку зниження швидкості їхніх реакцій із хлоридною кислотою?
а) Na, Mg, Zn, Fe, Cu;
б) Mg, Na, Fe, Zn, Cu;
в) Na, Mg, Fe, Cu, Zn;
г) Mg, Na, Zn, Cu, Fe.
- *7. За даними демонстраційного досліду побудуйте на міліметровому папері графік залежності швидкості реакції (вісь ординат) від температури (вісь абсцис). Чи проходить графік через початок координат? Яким буде температурний коефіцієнт швидкості цієї реакції, якщо температуру підвищити від 40 до 80 °С?
Цей контент створено завдяки Міністерству освіти і науки України
