Усі лабораторні роботи. 6-11 класи
Лабораторний дослід № 9
Тема: розв’язання експериментальних задач
Мета роботи: закріпити вміння складати план проведення хімічного експерименту, здійснювати розпізнавання та перетворення речовин на підставі знань про фізичні та хімічні властивості речовин, способи їх добування.
Реактиви: гранули цинку, цинк оксид, цинк гідроксид, магній карбонат, кальцій карбонат, купрум (II) оксид, купрум (II) гідроксид, вугілля, мідь, хлоридна кислота, розчини сульфатної кислоти, купрум (II) сульфату, купрум (II) хлориду, барій хлориду, калій хлориду, натрій хлориду, натрій сульфату, ферум (III) сульфату, цинк сульфату, магній сульфату, натрій карбонату, натрій гідроксиду, калій гідроксиду, лакмусу.
Обладнання: штатив для пробірок, пробірки, нагрівальний прилад, сірники, пробіркотримач.
Завдання № 1
|
Розчин кислоти |
Розчин лугу |
Вода |
|
|
Лакмус |
червоний |
синій |
фіолетовий |
В кожну пробірку додали лакмус. У пробірці з кислотою лакмус стає червоний, в пробірці з лугою — синім, у пробірці з водою — не змінюється.
Висновок: визначили розчини кислоти, лугу та воду, знаючи, що кислоти та луги змінюють забарвлення індикаторів.
Завдання № 2
|
Сульфатна кислота H2SO4 |
Натрій сульфат Na2SO4 |
|
|
Цинк |
Н2↑ |
без змін |
У кожну пробірку додали гранулу цинку. В пробірці з сульфатною кислотою спостерігається виділення газуватої речовини — водню, в пробірці з натрій сульфатом змін немає.
H2SO4 + Zn = ZnSO4 + Н2↑
Висновок: наявність атомів гідрогену у складі кислот можна довести взаємодією з металами, які розташовані у ряді активності металів до водню.
Завдання № 3
|
Na2СО3 |
NaCl |
|
|
HCl |
CO2↑ |
без змін |
В кожну пробірку додали хлоридну кислоту. В пробірці з натрій карбонатом спостерігається бурхливе виділення вуглекислого газу, в пробірці з натрій хлоридом реакція не відбувається.

Висновок: солі реагують з кислотами за умови, що утворюється осад або виділяється газ.
Завдання № 4
|
HCl |
КСl |
ВаСl2 |
|
|
Zn |
Η2↑ |
без змін |
без змін |
|
H2SO4 |
без змін |
BaSO4↓ |
|
|
AgNО3 |
AgCl↓ |
Відлити у чисті пробірки по 1 мл розчинів речовин, в кожну покласти гранули цинку. В одній пробірці спостерігається виділення водню:
Zn + 2НСl = ZnCl2 + Н2.
Залишилися розчини калій хлориду та барій хлориду. З двох пробірок, що містять нерозпізнані речовини, відлити у чисті пробірки по 10 мл розчинів, додати розчин сульфатної кислоти. В одній пробірці спостерігається утворення білого осаду:
H2SO4 + ВаСl2 = BaSO4↓ + 2НСl.
Залишився розчин калій хлориду. Щоб довести його наявність, додали розчин аргентум нітрату. Спостерігається утворення білого сирнистого осаду:
AgNO3 + КСl = AgCl↓ + KNO3.
Висновок: визначили розчини речовин, використовуючи знання про якісні реакції.
Завдання № 5
|
ZnSO4 |
MgSO4 |
|
|
NaOH |
Ζn(ΟΗ)2↓, який розчиняється у надлишку лугу |
Mg(OH)2↓ |
У кожну пробірку додали краплями розчин лугу. Спостерігали утворення білого осаду в кожній пробірці. Додали надлишок розчину лугу. В пробірці, де знаходився цинк сульфат, осад розчинився; в пробірці з магній сульфатом змін немає.
MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4
Завдання № 6
Купрум (II) оксид — порошок чорного кольору, магній оксид — порошок білого кольору.
Висновок: розпізнали речовини за фізичними властивостями.
Завдання № 7
|
ZnO |
MgCO3 |
|
|
HCl |
розчинення з утворенням безбарвного розчину |
СО2↑ |
В пробірки з цинк оксидом та магній карбонатом додали хлоридну кислоту. В одній пробірці спостерігається виділення газуватої речовини — вуглекислого газу.
Це магній карбонат:

У другій пробірці спостерігається утворення безбарвного розчину, це цинк оксид:
ZnO + 2НСl = ZnCl2 + Н2О.
Висновок: розпізнали речовини, знаючи, що оксиди та солі здатні реагувати з кислотами.
Завдання № 8
До порошку графіту з домішками порошкоподібного купрум (II) оксиду додали хлоридну кислоту, вміст пробірки трохи підігріли. Спостерігається утворення розчину блакитного кольору купрум (II) хлориду.
CuO + 2НСl = СuСl2 + Н2О.
Висновок: наявність домішок купрум (II) оксиду довели на підставі хімічних властивостей оксидів: вони реагують з кислотами з утворенням солі та води.
Завдання № 9
CuCl2 → Сu(ОН)2
1. Окиснення міді.
a) Cu → СuО →
Мідний дріт прожарили в полум’ї. Спостерігається утворення чорного нальоту купрум (II) оксиду.
б) 2Cu + О2 = 2СuО.
2. Взаємодія купрум (II) оксиду з хлоридною кислотою.
Дріт з нальотом купрум (II) оксиду занурили в хлоридну кислоту, вміст пробірки підігріли. Спостерігається утворення розчину блакитного кольору купрум (II) хлориду.
CuO + 2НСl → СuСl2 + Н2О.
3. Взаємодія розчину купрум (II) хлориду з лугами.
До розчину купрум (II) хлориду додали розчин натрій гідроксиду. Спостерігається утворення осаду синього кольору купрум (II) гідроксиду:
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl.
С → СО2 → К2СО3
1. Спалювання вугілля з утворенням карбон (IV) оксиду:
С + О2 = СО2.
2. Взаємодія кислотного оксиду з лугами з утворенням солі та води:
СО2 + 2КOН = К2СО3 + Н2О
3. Дія кислоти на розчин солі з утворенням газуватої речовини — карбон (IV) оксиду:
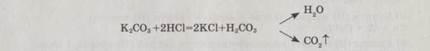
в) Fe2(SO4)3 → Fe(OH)3 → Fe2O3.
1. Взаємодія розчину солі з лугами з утворенням нерозчинної основи.
До розчину ферум (III) сульфату додали розчин натрій гідроксиду. Спостерігається утворення осаду червоно-бурого кольору ферум (III) гідроксиду:
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4.
2. Розкладання нерозчинної основи під час нагрівання з утворенням основного оксиду.

Ферум (III) гідроксид нагріли. Спостерігається утворення кристалічного ферум (III) оксиду бурого кольору:
![]()
Висновок: здійснили перетворення на основі знань про хімічні властивості та способи добування оксидів, основ, солей.
Завдання № 10
а) До порошку чорного кольору купрум (II) оксиду додали сульфатну кислоту, вміст пробірки нагріли. Спостерігається утворення розчину блакитного кольору купрум (II) сульфату:
CuO + H2SO4 = CuSO4 + Н2О.
б) До розчину ферум (III) сульфату додали розчин натрій гідроксиду. Спостерігається утворення осаду червоно-бурого кольору ферум (III) гідроксиду:
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4.
в) Нерозчинний у воді купрум (II) гідроксид синього кольору нагріли. Спостерігається утворення речовини чорного кольору купрум (II) оксиду та води на стінках пробірки:
![]()
Висновок: добули запропоновані речовини на основі знань про способи добування основ, солей, оксидів.
Завдання № 11
1) Цинк сульфат
а) цинк + сульфатна кислота → цинк сульфат + водень:
Zn + H2SO4 = ZnSO4 + Н2↑
б) цинк оксид + сульфатна кислота → цинк сульфат + вода:
ZnO + H2SO4 = ZnSO4 + Н2О.
в) цинк гідроксид + сульфатна кислота → цинк сульфат + вода:
Zn(OH)2 + H2SO4 = ZnSO4 + 2Н2О.
2) Карбон (IV) оксид
а) вугілля + кисень → карбон (IV) оксид: С + О2 = СО2.
б) натрій карбонат + сульфатна кислота → натрій сульфат + вода + карбон (IV) оксид:
в) нагрів кальцій карбонат → кальцій оксид + карбон (IV) оксид:
![]()
3) Купрум (II) хлорид. а) мідь + хлор → купрум (II) хлорид:
Cu + Сl = СuСl2.
б) купрум (II) оксид + хлоридна кислота → купрум (II) хлорид + вода:
CuO + 2НСl = СuСl2 + Н2О.
в) купрум (II) гідроксид + хлоридна кислота → купрум (II) хлорид + вода:
Cu(OH)2 + 2НСl = СuСl2 + 2Н2О.
г) купрум (II) сульфат + барій хлорид → купрум (II) хлорид + барій сульфат:
CuSO4 + ВаСl2 = CuCl2 + BaSO4↓.
Висновок: добули різними способами запропоновані речовини, знаючи способи добування солей та оксидів.
Загальний висновок: розв’язали експериментальні задачі на основі знання фізичних, хімічних властивостей та способів добування оксидів, кислот, лугів, солей.
Цей контент створено завдяки Міністерству освіти і науки України
